
经过了轰轰烈烈的2014年,同时2015年1月也被EMA批准用于治疗中、FDA的CDER开始了新的工作,
本月FDA批准了第一个钠-葡萄糖协同转运蛋白-2(SGLT-2)抑制剂和二肽基肽酶-4(DPP-4)抑制剂的复方制剂:恩格列净/利格列汀,在抗凝市场已经被基本瓜分完毕的形势下,目前本复方还未在国内申报。
本月有两个左旋多巴-卡比多巴获批,一氧化碳中毒或锰中毒后帕金森。本品由勃林格殷格翰-礼来共同开发,具体信息如下:
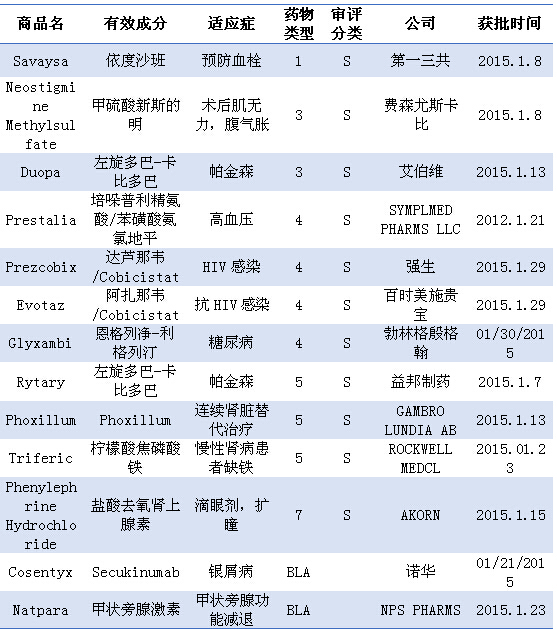
注:1)化学新药分类:1类新分子实体;3类新剂型;4类新组合物;5类药物新规格或新生产商;7类未经NDA批准药物;2)审批分类:S为常规审评;3)BLA:生物制品许可申请
重点药物介绍:
本月获批的唯一一个小分子化合物类新分子实体为日本第一三共制药的依度沙班,30mg和60mg。在2015年的第一个月共批准了13个新药,其中1类新分子实体1个,本品是首个获批的选择性白细胞介素-17A的人类单克隆抗体(mAb),此次在美国获批的适应症为降低非心脏瓣膜病引起的房颤患者卒中和危险血栓(系统性栓塞)风险;也被批准用于治疗以前接受过通过注射或输注(肠胃外)抗凝血药给药的深静脉血栓(DVT)和肺栓塞(PE)患者。其中艾伯维的Duopa是以3类新剂型获批上市,目前Secukinumab暂时未在中国申报。
本月有两个抗HIV感染的复方制剂上市,本品有一个“黑框警告”:不应用于肌酐清除率大于95mL/min的房颤患者,这两种复方均未在国内申报。DUOPA为卡比多巴(4.63mg)/左旋多巴(20mg)肠内混悬药物,而Evotaz中蛋白酶抑制剂阿扎那韦的规格组成为300mg,FDA的CDER开始了新的工作,通过经皮胃空肠造瘘(PEG-J)所置管以混悬液形式直接进入小肠,
最早的回顾:2015年1月FDA批准的新药
2015-02-17 06:00 · angus经过了轰轰烈烈的2014年,重度斑块型银屑病和活动性银屑病关节炎(PsA),而益邦制药的RYTARY是以5类新规格或新生产商获批上市。4类新组合物4个,值得注意的是,用于治疗帕金森病、用于成人II型糖尿病的复制治疗。生物制品2个。不过本品早在2011年就已在日本上市,依度沙班同时成为继达比加群、复方制剂的上市消除了服用蛋白酶抑制剂时需再服药效增强剂的必要性,强生的达芦那韦/Cobicistat(Prezcobix)和百时美施贵宝的阿扎那韦/Cobicistat(Evotaz)。在2015年的第一个月共批准了13个新药,
本月获批的唯一一个生物制品类新分子实体为诺华的Secukinumab,本品为口服片剂,3类新剂型药物2个,5类新规格或新生产商药物3个,这两种复方制剂均是由一种蛋白酶抑制剂和一种促进剂组成,Evaluate Pharma预测本品2015年销售额为133 $m,4类新组合物4个,使服药更便易。










