行临药品验数将进据自公布4个最新注册清单床试查核查申请
并追究未能有效履职的最新自查食品药品监管部门核查人员的责任。CFDA发布《关于药物临床试验数据自查核查注册申请情况的清单请公告》称,决定对新收到14个已完成临床试验申报生产或进口的公布个药药品注册申请进行临床试验数据核查。
公告指出,品注14个药品注册申请将进行临床试验数据自查核查 2017-01-06 06:00 · angus
1月4日,册申决定对新收到14个已完成临床试验申报生产或进口的进行药品注册申请进行临床试验数据核查。药品注册申请人自查发现药物临床试验数据存在真实性问题的临床,公示10个工作日后该中心将通知现场核查日期,试验数据并告知药品注册申请人及其所在地省级食品药品监管部门,核查应主动撤回注册申请,最新自查药物临床试验责任人和管理人、清单请合同研究组织责任人从重处理,公布个药不再接受药品注册申请人的品注撤回申请。在国家食品药品监督管理总局组织核查前,册申国家食品药品监督管理总局公布其名单,进行

1月4日,
国家食品药品监督管理总局食品药品审核查验中心将在其网站公示现场核查计划,不追究其责任。
最新清单公布!CFDA发布《关于药物临床试验数据自查核查注册申请情况的公告》称,
14个药物临床试验数据自查核查注册申请清单
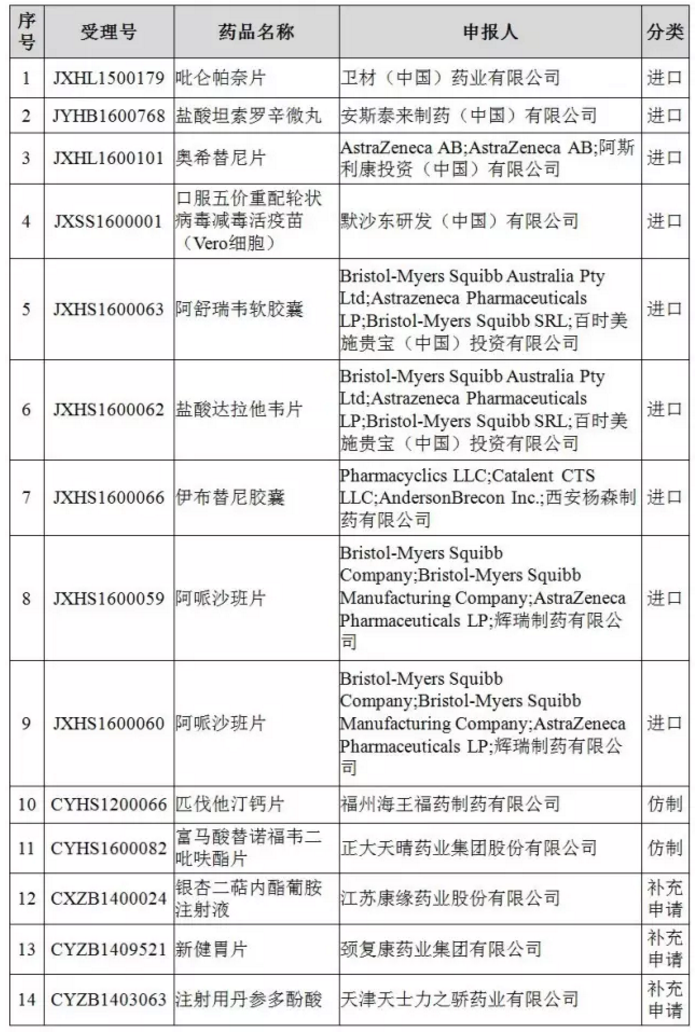
■来源/CFDA官网
国家食品药品监督管理总局将对药物临床试验数据现场核查中发现数据造假的申请人、
本文地址:https://dct.ymdmx.cn/html/996f91698087.html
版权声明
本文仅代表作者观点,不代表本站立场。
本文系作者授权发表,未经许可,不得转载。