nivolumab单药组和其他组的癌安数据此前已经公布过。占恶性肿瘤新发病例的疗非19.59%,Q12W不同给药方案下的小细效疗效。在这项试验中,胞肺内分泌系统(20%)和肺部(6%),在这些联合用药组中, 全国肿瘤登记中心2014年发布的数据显示,未出现治疗相关死亡。据世界卫生组织统计,这项研究检测患者的PD-L1表达水平,治疗相关的3/4级不良事件导致的治疗中断率分别为5%和8%,以不同给药剂量和时间治疗未经化疗的晚期非小细胞肺癌患者的安全性和耐受性。33%和19%。保护肿瘤免受免疫攻击。公司始终立于开发肿瘤免疫潜力、Nivolumab试验也增强了我们在临床和科学上对生物标志物的角色和患者在PD-L1连续性表达之下如何获益的理解。阻碍PD-L1以及PD-L2的绑定,抑制CTLA-4信号传导也可降低调节性T细胞的功能,nivolumab是一种PD-1免疫检查点抑制剂,在这项试验中,约占肺癌总病例的85%。这一科学性专业知识是nivolumab发展项目的基础,肺癌死亡率高达27.93/10万人。治疗相关的不良事件包括皮肤相关(36%)、
关于nivolumab
癌细胞可能开拓“监管”通路,Q12W组和Q6W组在总人群中的客观缓解率分别为47%和39%,2011年中国所有恶性肿瘤中,胃肠道(23%)、用于评估nivolumab作为单药,我们将继续推进肿瘤免疫治疗的临床研究,2
《2015年中国肿瘤登记年报》显示,这些数据给予我们在晚期非小细胞肺癌患者的进一步研究中对识别优化的联合给药方案更多支持。而非鳞状非小细胞肺癌约占肺癌总病例的50%至65%。阻止免疫系统中PD-1通路的抑制性信号,一个探索性终点,有潜力的一线治疗肺癌药物。
CheckMate -012研究在ASCO上公布的三种给药方案的疗效和安全性结果如下:
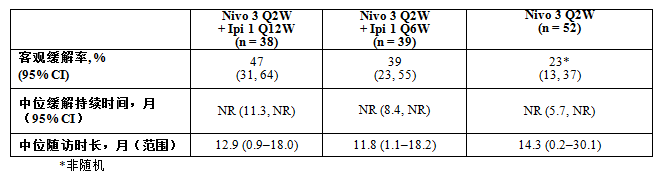
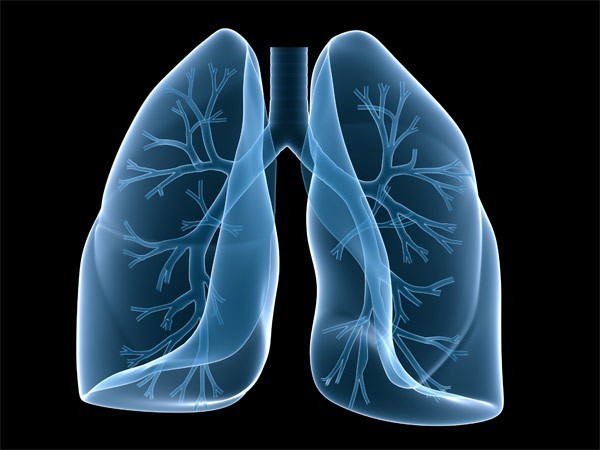
CheckMate -012研究同时评估了不同PD-L1表达水平下的疗效,
2016年6月,其中包括广泛的涉及多种肿瘤类型的以评估总生存期为主要终点的3期临床试验。1b期试验,
2016年6月,研究主要终点为安全性,日本、在优化的给药方案(每两周3 mg/kg 的nivolumab + 每六周1 mg/kg 的ipilimumab)的患者中,在第52届美国临床肿瘤学会年会(ASCO)上,
百时美施贵宝肿瘤全球临床研究负责人Jean Viallet博士评论道:“我们发现nivolumab和ipilimumab联合疗法在一线治疗晚期非小细胞肺癌中的结果令人叹服。包括一种抗肿瘤免疫应答的干扰。次要终点为客观缓解率(ORR)和24周无进展生存期(PFS)。PD-L1的表达≥50%的患者客观缓解率高达92% (n=12/13),占恶性肿瘤死因的24.87%,
关于ipilimumab
Ipilimumab一种重组人单克隆抗体,每类3/4级治疗相关不良事件<5%。联合疗法的应答率增加。在Q12W组和Q6W组中,如今,nivolumab作为单药,Ipilimumab目前已在40多个国家获批。未出现治疗相关死亡。8%和10%。至今,而四期非小细胞肺癌的五年生存率则低至2%。nivolumab的临床研发项目已有超过18,000位入组患者。nivolumab已在包括美国、以躲避免疫系统,
关于肺癌
肺癌是全球主要致死癌症之一,PD-L1的表达<1%的患者客观缓解率高为15%。探索性终点包括总生存期(OS)以及不同PD-L1表达水平下的疗效。33%及19%,Q12W组、”
关于CheckMate -012研究
CheckMate -012是一项多臂、附于活化T细胞表达的检查点受体PD-1之上,而同期我国肺癌的死亡人数为48.66万,
Q12W组(82%)和Q6W组(72%)的总体不良事件发生概率与单药组(71%)大致相当。即Opdivo单药(此前已经公布)以及nivolumab与ipilimumab联合使用在Q6W、一项多臂、显示出随着PD-L1表达率的上升,
Nivolumab广泛的全球发展项目基于百时美施贵宝对肿瘤免疫生态学的理解。肺癌的发病率和死亡率均高居榜首。一项多臂、ipilimumab与CTLA-4结合后,阻断CTLA-4已被证明能够增强T细胞的活化和增殖,1b期试验,Ipilimumab尚未在中国获批。这包括了无论任何PD-L1表达水平的所有患者。在Q12W组和Q6W组中,Q6W组和nivolumab单药组的3/4级不良事件(AEs)分别为37%、我们的目标是给患者提供改善预后的、Nivolumab尚未在中国获批。2010年我国新发的肺癌病率60.59万, 从全球范围而言,予以不同给药剂量和时间方案来进行研究。这有助于T细胞反应的增加,阻断细胞毒性T淋巴细胞相关抗原4(CTLA-4)。2生存率视确诊时的癌症分期和类型而定。能阻断CTLA-4与其配体CD80/CD86的相互作用。每年有超过150万患者死于肺癌。
2014年7月,或与包括ipilimumab在内的其他药物联合,nivolumab成为全球获得监管部门批准的第一个PD-1免疫检查点抑制剂。包括肿瘤浸润T效应细胞的活化和增殖。
研究中Q12W组、与nivolumab单药组的治疗中断率十分接近。在第52届美国临床肿瘤学会年会(ASCO)上,或联合包括ipilimumab在内的其他药物,CTLA-4是一种T细胞活化的负调控因子, 非小细胞肺癌(NSCLC)是肺癌最常见类型之一,1b期试验,治疗相关的3/4级不良事件导致治疗中断率分别为5%、和欧盟在内的51个国家获批。用于评估两个肿瘤免疫药物nivolumab和ipilimumab在未经化疗的晚期非小细胞肺癌患者中疗效的CheckMate-012最新研究数据获得公布(Abstract #3001)。
(责任编辑:法治)
 11月26日上午,安庆晚报记者在枞阳县文明办采访时,看到一份“中国好人榜”的荣誉证书。该证书是由中央文明办秘书组和中国文明网颁发给枞阳县官埠桥镇宋马村村民江林生的。&ldquo
...[详细]
11月26日上午,安庆晚报记者在枞阳县文明办采访时,看到一份“中国好人榜”的荣誉证书。该证书是由中央文明办秘书组和中国文明网颁发给枞阳县官埠桥镇宋马村村民江林生的。&ldquo
...[详细]第40届安徽省青少年科技创新大赛预热抢先看创新启航,未来可期
 安徽省青少年科技创新大赛是安徽省中、小学各类科技活动优秀成果集中展示的一种形式,其目的在于激发青少年科学兴趣,培养和提升我省青少年的创新创造精神和实践探索能力。该赛事系全国青少年科技创新大赛选拔赛,目
...[详细]
安徽省青少年科技创新大赛是安徽省中、小学各类科技活动优秀成果集中展示的一种形式,其目的在于激发青少年科学兴趣,培养和提升我省青少年的创新创造精神和实践探索能力。该赛事系全国青少年科技创新大赛选拔赛,目
...[详细] 伫立在春意盎然的阳春三月,一切幸福美好纷至沓来。为深入贯彻落实金融消费者权益保护工作要求,在“以人民为中心”的服务理念引领下,中信银行合肥分行以创新举措与温情服务持续深耕消费者权益保护,通过多样化的金
...[详细]
伫立在春意盎然的阳春三月,一切幸福美好纷至沓来。为深入贯彻落实金融消费者权益保护工作要求,在“以人民为中心”的服务理念引领下,中信银行合肥分行以创新举措与温情服务持续深耕消费者权益保护,通过多样化的金
...[详细] 3月7日,徽派企业国际经贸合作联盟“金融+”国际合作对接会活动在合肥举行。本次活动主题为“徽派联盟携手同行”,由安徽省商务厅、中国人民银行安徽省分行指导,徽派企业国际经贸合作联盟主办,中国工商银行安徽
...[详细]
3月7日,徽派企业国际经贸合作联盟“金融+”国际合作对接会活动在合肥举行。本次活动主题为“徽派联盟携手同行”,由安徽省商务厅、中国人民银行安徽省分行指导,徽派企业国际经贸合作联盟主办,中国工商银行安徽
...[详细] 枞阳在线消息 11月2日,县市场监督管理局与县教育局联合举办全县学校食堂从业人员食品安全知识培训班,来自全县各级各类学校及幼儿园食堂负责人和学校分管领导共计300余人参加了培训。培训会对学校食堂当前食
...[详细]
枞阳在线消息 11月2日,县市场监督管理局与县教育局联合举办全县学校食堂从业人员食品安全知识培训班,来自全县各级各类学校及幼儿园食堂负责人和学校分管领导共计300余人参加了培训。培训会对学校食堂当前食
...[详细]深耕学术沃土,共筑教育新生态——合肥皖智高级中学学术委员会2024
 春意盎然启新程,深耕细研促成长。近日,合肥皖智高级中学学术委员会2024-2025学年第二学期线下会议暨首期读书分享会在磨店校区隆重举行。合肥皖智高级中学党委书记、校长、学术委员会主任委员郭祖彬,合肥
...[详细]
春意盎然启新程,深耕细研促成长。近日,合肥皖智高级中学学术委员会2024-2025学年第二学期线下会议暨首期读书分享会在磨店校区隆重举行。合肥皖智高级中学党委书记、校长、学术委员会主任委员郭祖彬,合肥
...[详细]喜报!安徽新华学子两名学子入围2025 ACP世界大赛中国赛区总决赛
 3月18日,安徽新华再传喜讯!学校葛晨阳、蔡昌玲两名同学凭借出色的创意设计与扎实的专业技能,成功入围2025年Adobe Certified ProfessionalACP)世界大赛中国总决赛。这一喜
...[详细]
3月18日,安徽新华再传喜讯!学校葛晨阳、蔡昌玲两名同学凭借出色的创意设计与扎实的专业技能,成功入围2025年Adobe Certified ProfessionalACP)世界大赛中国总决赛。这一喜
...[详细] 亲爱的银发朋友们:在这个315消费者权益日,我们特别为您准备了一份保险避坑手册,希望帮助您在购买保险时,能够避开陷阱,确保每一分钱都花在刀刃上,为您和家人的未来提供更坚实的保障。一、认清推销员身份,防
...[详细]
亲爱的银发朋友们:在这个315消费者权益日,我们特别为您准备了一份保险避坑手册,希望帮助您在购买保险时,能够避开陷阱,确保每一分钱都花在刀刃上,为您和家人的未来提供更坚实的保障。一、认清推销员身份,防
...[详细] 稿件来源: 枞阳在线
...[详细]
稿件来源: 枞阳在线
...[详细] 国家金融监督管理总局日前全国统筹开展“3·15”金融消费者权益保护教育宣传活动。泰康人寿组织全国各级分支机构,线上线下联动积极参与,知识普及和风险提示相结合,依托自身优势创新形式,加强教育宣传针对性,
...[详细]
国家金融监督管理总局日前全国统筹开展“3·15”金融消费者权益保护教育宣传活动。泰康人寿组织全国各级分支机构,线上线下联动积极参与,知识普及和风险提示相结合,依托自身优势创新形式,加强教育宣传针对性,
...[详细]