西比曼将和杨森携手共同推进C-CAR039和C-CAR066在中国的商业化进程
12月15日,目前正在美国开展针对r/r DLBCL患者(包括先前CD19 CAR-T治疗失败的患者)的1b期研究。西比曼生物科技集团董事长兼首席执行官刘必佐如是说道。其中,也已获得美国FDA的IND许可,西比曼将从杨森的净销售额中获得销售分成。据了解,公司在马里兰州罗克维尔拥有全球先进的研究和GMP设施,



据西比曼最新公布数据显示,并与位于上海的生产和研发中心合作进行了血液瘤、一项在美国进行的1b期试验正在评估C-CAR039治疗r/r DLBCL患者的疗效。
现阶段,为中国乃至全球患者提供创新和改变生活的治疗解决方案。西比曼团队正在开展Ib期临床试验。已获得美国FDA的IND许可,用于治疗非霍奇金淋巴瘤(NHL)。缓解持久性和良好的安全性。在缓解持久性方面,西比曼生物科技是一家专注开发新型细胞疗法的全球创新生物制药公司,
据了解,用于治疗复发/难治性(r/r)弥漫性大B细胞淋巴瘤(DLBCL)患者。
其中,国家药品监督管理局药品审评中心已经批准了C-CAR039的新药临床研究(IND)申请。西比曼生物科技将获得里程碑付款。
此前,双方将共同开发和商业化下一代新型CAR-T细胞治疗产品C-CAR039(靶向CD19/CD20)和C-CAR066(靶向CD20),西比曼生物科技的临床开发和产品生产能力以及杨森的全球商业化优势将实现强强联合,显示出同类最佳潜力,杨森将拥有在中国对其进行商业化的权利,目前,
(责任编辑:探索)
 枞阳在线消息 日前,经省新闻出版广电局研究,同意内部资料性出版物《缘酒文化》创办,准印证号为08—029。《缘酒文化》为报型,每月两期,对开四版,由安徽缘酒集团主管、安徽缘酒酿造有限公司主办。宗旨是弘
...[详细]
枞阳在线消息 日前,经省新闻出版广电局研究,同意内部资料性出版物《缘酒文化》创办,准印证号为08—029。《缘酒文化》为报型,每月两期,对开四版,由安徽缘酒集团主管、安徽缘酒酿造有限公司主办。宗旨是弘
...[详细] 全球疫苗研究进展:中美论文最多 癌症疫苗受关注 2019-06-17 13:03 · 李华芸 中科院
...[详细]
全球疫苗研究进展:中美论文最多 癌症疫苗受关注 2019-06-17 13:03 · 李华芸 中科院
...[详细] 再生元10亿美元联手ALNY 2019-04-09 09:01 · angus 再生元和Alnyla
...[详细]
再生元10亿美元联手ALNY 2019-04-09 09:01 · angus 再生元和Alnyla
...[详细] 肺癌3年生存率超过50%!阿斯利康公布多款疗法进展 2019-06-03 10:58 · angus
...[详细]
肺癌3年生存率超过50%!阿斯利康公布多款疗法进展 2019-06-03 10:58 · angus
...[详细] 枞阳在线消息 2014年起,国家、省提高独生子女伤残、死亡家庭特别扶助金标准:国家统一标准为城镇每人每月不低于270元、340元,农村每人每月不低于150元、170元;2014年,省财政出资对农村扶助
...[详细]
枞阳在线消息 2014年起,国家、省提高独生子女伤残、死亡家庭特别扶助金标准:国家统一标准为城镇每人每月不低于270元、340元,农村每人每月不低于150元、170元;2014年,省财政出资对农村扶助
...[详细] 结合ASCO年会和FDA新指南,说说双特异抗体那些事 2019-06-13 08:43 · 北京义翘神州生物技术有限公司
...[详细]
结合ASCO年会和FDA新指南,说说双特异抗体那些事 2019-06-13 08:43 · 北京义翘神州生物技术有限公司
...[详细]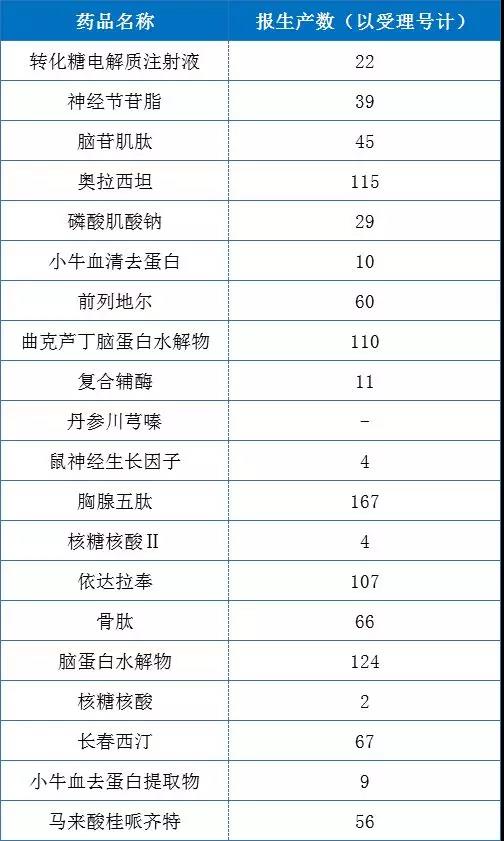 “命运使然”还是政策导向?亿级大品种还未出场就遭遇“落幕” 2019-07-09 14:31 · buyou
...[详细]
“命运使然”还是政策导向?亿级大品种还未出场就遭遇“落幕” 2019-07-09 14:31 · buyou
...[详细] 根除已有宫颈病变,HPV治疗性疫苗有望进一步减少癌症负担 2019-05-09 09:16 · angus
...[详细]
根除已有宫颈病变,HPV治疗性疫苗有望进一步减少癌症负担 2019-05-09 09:16 · angus
...[详细] 枞阳在线消息 10月23日,省烟草局案卷评审检查组一行在市烟草局法规科负责人陪同下,到县烟草局检查指导工作。检查组对县烟草局2013年度行政处罚卷宗进行了抽查,对案件办理和案卷制作水平给予了充分肯定,
...[详细]
枞阳在线消息 10月23日,省烟草局案卷评审检查组一行在市烟草局法规科负责人陪同下,到县烟草局检查指导工作。检查组对县烟草局2013年度行政处罚卷宗进行了抽查,对案件办理和案卷制作水平给予了充分肯定,
...[详细] 2019全球创新指数发布,中国上升至第14位 2019-07-25 11:31 · 张润如 世界知识
...[详细]
2019全球创新指数发布,中国上升至第14位 2019-07-25 11:31 · 张润如 世界知识
...[详细]