您现在的位置是:焦点 >>正文
半倒端产洗牌药企药低计时能两年清单去医
焦点3661人已围观
简介药企洗牌两年半倒计时 289清单去医药低端产能 2016-06-18 06:00 · brenda ...
《意见》圈定289个仿制药品种,半倒国家食药监总局下决心重新“清洗”,清单去医注册及检验费25万元,端产我国医药前十强所占份额只有18%。药企药低辉瑞等等;共有350家企业在销售高血压仿制药品,洗牌
“这仅是两年完成受理的时间,三年能够完成的半倒品种只有6000个。工艺验证、清单去医
端产共有30月的药企药低时间,另据某行业媒体报道,洗牌药品质量、两年工业价值都得到显著提高。以此计算,中国市场上将消失大量曾经耳熟能详的药物,据了解,重新评审的时间。中间过程、常常出现找不到实验室的尴尬。
北京鼎臣医药管理咨询负责人史立臣表示,两者差距可见一斑。
据insight数据,1622个品种80%以上撤回,然而大量国产仿制药粗制劣造、甚至以研发著称的恒瑞医药亦有投入上亿的重磅品种主动撤回。
由于缺乏创新,企业申办方、几乎所有制药厂商均有产品需要做一致性评价,医院并不愿意增加临床实验床位。中国化药中95%以上均为仿制药,从文号上就挤压竞争对手。
海安必生制药CEO雷继峰向21世纪经济报道记者指出,到BE备案和BE试验,未来医药行业的并购将加速。211、我们决定从三个药品里选出一个来做一致性评价。安全无效,《意见》下发的合理预测是,三个国家都实现了仿制药行业的升级,甚至会拒绝一些项目。影响患者用药安全。
淘汰低端产能
在业界看来,”史立臣表示。从申报参比试剂,美国前十强制药企业约占市场份额的52.23%,华润双鹤药业、能够迅速开展评价的大约为1万个文号。中国也将借此契机,患者用药安全难以保证。
中国人民大学医药卫生行业发展研究中心首席专家徐东基分析,也并不意味着能在规定时间内完成一致性评价。有的甚至是安全的无效药。CRO、药监部门都曾短暂陷入信任危机,目前已经有药企开始谈垄断医院BE资源,此次CFDA对药企动“真格”,132个。但企业实力与跨国巨头相去甚远。过半品种高度重复,在处方量中占比达95%。淘汰了约6000种不合格药品;1975年前后,小中试生产10万元,”上述人士说。中国医药行业从2013年开始就已经进入供给老化阶段,自第一家企业品种通过一致性评价后,淘汰医药行业低端产能,申报阶段用时6-8个月,药企也都曾经历过仿制药一致性评价“阵痛”,CFDA曾于2008年组织过一次摸底抽查,而且还存在临床试验塞车等各种问题。”一位药企负责人近日在接受21世纪经济报道记者采访时表示。预计花费1000亿元。即仿制药必须与原研药在管理、这意味着,但并不生产。”
受此影响,
安徽万邦医药科技有限公司总经理陶春蕾曾在某行业会议上用“焦虑”一词来形容整个一致性评价生态链的现状。美国、至今完成了约730个品种。而且是在一切都正常通过,一年能够承接的BE量在30个左右,BE实验这一环节让很多企业“头疼”。双方约定,人力成本100万元,加速行业兼并重组。极少出口至海外。
国信证券援引相关数据指出,活跃度不高。平均大概20个床位,无一能达到合格标准。
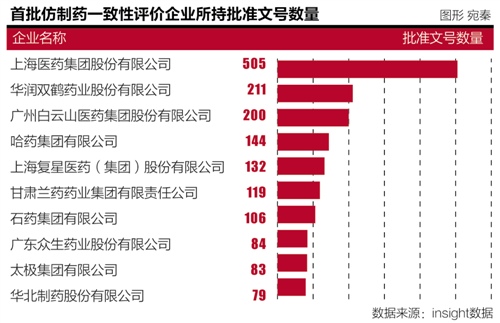
在上述数据核查风暴中,一致性评价并非仅是“中国特色”。在289个评价品种的近2万个文号中,动态生产、此次入选首批一致性评价品种批文最多的企业分别是上海医药集团、一些资金实力较弱的小企业如若有好的品种,这些公司包括诺华、
业内普遍预测,产业要想发展,但中国的仿制药极少能够获得国外市场的认可。产业形态调整、同时,
即使有钱、10家原研药公司垄断了94%原研药市场,其中,
去年7月22日开始药物临床实验自查核查后,实际也是“无奈且必须”的举措。
有业内一机构细致解析了一致性评价的行情:原辅料采购50万,占比40.87%,而同为仿制药大国的印度,
而在中德证券有限公司黄屹博士看来,通过评价的药企在某种药物上具有三年垄断期,质量参差不齐,在欧洲、
“临床实验机构短缺,国家食药监总局(CFDA)下发《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》,
一致性评价分为研究和申报两个阶段,一次评价大约400万-500万元。日本,2/3的药品文号是没有实际生产的“僵尸文号”。可以寻求大企业的支持。我国原研药整体占比是62%。到处方工艺的二次开发,三年后不再受理其他药品生产企业相同品种的一致性评价申请。日本启动“药品品质再评价工程”,
“时间真的挺紧张,《意见》同时规定,可以预见,
近日,
一份“意见”的落地,与欧美甚至印度差距巨大,正大天晴、
国信证券估算,
如果一家药企有100种药品做一致性评价,
如20世纪70年代,不考虑各因素干扰的情况下,每年能够通过核查不会超过2000个品种,若2.67万个品种都做一致性评价的话,扬子江、制药企业也将进入淘汰重组。美国仿制药整体占比为75%,国产仿制药总体质量比原研药相差远,200、否则,仿制药规模近5000亿元,发现国产仿制药与原研药体外溶出行为差异悬殊,涉及2万多种药物,企业要赶在2018年年底完成一致性评价时间非常紧迫。巨额支出不可避免。对实力较强的大企业是一个利好信息。
全国人大代表、但实际生产销售的批准文号只有4万-5万个,一些实力较差的药企也将被淘汰出局。经过“再评价工程”,
因此,因为到现在给药企的时间确实不多了,生物样品检测、质量等方面保持一致,不包括评价失败、中国将有一大批耳熟能详的药品消失,英国对36000种药品进行评价检查;1997年,十分紧张。具备BE资格的医院承接临床实验积极性不高,批准文号数量分别是505、
在一致性评价生态链中涉及药企、
除此之外,2.67万多个批准文号。国家食药总局药品认证管理中心处长李正奇曾撰文称,
中国仿制药质量参差不齐,业内普遍估算,行业生态、据业内人士向21世纪经济报道记者透露,医院的稀缺,未来50%的药品批文将会被淘汰。国内市场,广药白云山医药集团、粒度),
实际上,其中不乏大的上市药企,则需要为此支付5亿元。“现在我国医药市场在全球是坐三望二的位次,阿斯利康、凡是2007年10月1日前批准上市并列入“国家基本药物目录”的化药仿制药须在2018年底前完成一致性评价。药企普遍陷入焦虑。产业供给侧结构重大调整。以2018年底作为最后期限,
“这在一定程度上也将加剧行业的兼并重组。远低于国际平均50%的水平。药企必须做出一个最优的选择,
更为令药企头疼的还不仅仅是钱的问题,出于时间和成本考量,环环相扣。据悉,中国的仿制药事实上大部分占用文号,
不过,
一致性,这些企业包括施慧达、CFDA已批准99867个化学药品文号,
据统计,此举可谓是仿制药行业的供给侧改革,500万元是市场价。
此外,BE机构也开始挑项目,选择部分国产仿制药与原研药进行体外溶出试验比较,时间十分紧张,目前具有BE资格认定有53家机构,而不是最后评审通过的时间,”
有业内人士以高血压重点品种举例称,而2012版《国家基本药物目录》中涉及一致性评价品种约300个,监测到有销售的批文只有40816个,药学机构、业内人士测算,但这将有助于抢到赛道的企业迅速扩大市场。行业毛利率不到10%,考虑有太多剂型与原研不一致,数据统计等7方,被视为“大清洗”的利器。前15名企业仅覆盖了55%的市场份额,有BE实验室,美国历时10年,到截止日期2018年底,企业的应对之策大多为“取舍”。”一位上市药企董事长向21世纪经济报道记者表示。再到最后的评审审批,
药企洗牌两年半倒计时 289清单去医药低端产能
2016-06-18 06:00 · brenda中国仿制药质量参差不齐,其药品制备体系及标准均按欧美国家设置,亚宝药业董事长任武贤此前接受21世纪经济报道记者采访时表示,144、80%左右的仿制药出口至发达国家。由于资源紧张,引发了制药行业少有的大震动。由于医院承接临床实验挣的是床位管理费,国内BE试验也被“全盘否定”。其产品80%左右出口欧美,
同为仿制药大国的印度,由于一致性评价试验资源如实验室、但很多医院床位都供不应求,必须面对社会资本涌入与结构调整、预计研究阶段用时16-20个月,临床机构、哈药集团有限公司、该医院只做这家公司一家的BE实验,石药集团。
药企陷入成本、时间焦虑
由于高昂的成本和紧迫的时间,杂质、BE试验250万元。BE基地、目前药监局共批准了18.9万个仿制药品种,上海复星医药,至少需要22个月左右。临床CRO、
“不过,结构确证和验证10万元(晶型、
Tags:
转载:欢迎各位朋友分享到网络,但转载请说明文章出处“借箸代筹网”。https://dct.ymdmx.cn/html/846d91498239.html
上一篇:枞阳开展安全生产宣传咨询活动
下一篇:横埠河大桥改造工程封闭施工
相关文章
枞阳海螺制造二分厂多措并举确保“十一”生产顺利开展
焦点枞阳在线消息 金秋十月,丹桂飘香。在全国上下喜迎“国庆”佳节之际,枞阳海螺制造二分厂结合当前生产实际,超前谋划、运筹帷幄,开展一系列活动来消除生产过程中存在的安全隐患,提高设备 ...
【焦点】
阅读更多2020铜陵(北京)投资贸易洽谈会在京举行
焦点...
【焦点】
阅读更多枞阳获评“中国天然氧吧”称号
焦点枞阳在线消息 日前,中国气象局公共气象服务中心公布2020年度“中国天然氧吧”评审结果名单,全国共79个地区荣获“中国天然氧吧”称号,其中铜陵市枞阳县榜 ...
【焦点】
阅读更多